Fundamento
Tiempo que tarda en coagular la sangre extraída recientemente mediante punción.
Material necesario
Baño de agua
Capilar azul
Lanceta
Gasa
Cronómeto
Plastilina
Muestra
Sangre capilar
Reactivos
Alcohol
Técnica
Primero preparamos la zona donde vamos a realizar la punción. En este caso en el dedo índice.
Desinfectamos con una gasa embebecida con alcohol y dejamos secar. Posteriormente procedemos a la punción y automáticamente ponemos el cronómetro. Extraemos la sangre con un capilar azul. Lo llenamos hasta la mitad del mismo aproximadamente. Y en el extremo que ha entrado la sangre tapamos con plastilina. Introducimos el capilar por la mitad en el baño de agua preparado anteriormente a 37ºC y sin dejar de moverlo. El tiempo de coagulación será cuando la sangre deje de moverse. En ese momento paramos el cronómetro.
Resultados obtenidos
El tiempo de coagulación ha sido de 134 segundos.
lunes, 30 de marzo de 2015
XXXVI Prueba de Rumpel-Leede
Fundamento
Consite en evaluar la resistencia que ofrecen las paredes capilares al aumento de la presión intracapilar y a la anoxia.
Material necesario
Rotulador
Esfingmomanómetro
Fonendoscopio
Reloj
Técnica
Primero hay que observar la posible presencia de petequias. Después, medimos la presión arterial al paciente, tanto la sistólica como la diastólica.
Una vez medida hacemos la media de la misma.
Para la determinación de petequias utilizamos el otro brazo. Hacemos un redondel en el antebrazo, que será donde determinemos el contaje de petequias en el caso que las hubiese.
Para ello, ensuflamos hasta la media de la medida de la presiones medidas anteriormente. Mantenemos esta presión durante 5 minutos.
Finalmente, retiramos el esfingmomanómetro y contamos las posibles petequias.
Lectura de los resultados
Las petequias se aprecian como pequeñas manchas cutáneas de color rojizo, que están constituidas por acúmulos de sangre, y que no desaparecen cuando se ejerce una compresión con el dedo sobre ellas.
Deben aparecer menos de 10.
En este caso no han aparecido ninguna, por tanto, el paciente está en perfectas condiciones.
Consite en evaluar la resistencia que ofrecen las paredes capilares al aumento de la presión intracapilar y a la anoxia.
Material necesario
Rotulador
Esfingmomanómetro
Fonendoscopio
Reloj
Técnica
Primero hay que observar la posible presencia de petequias. Después, medimos la presión arterial al paciente, tanto la sistólica como la diastólica.
Una vez medida hacemos la media de la misma.
Para la determinación de petequias utilizamos el otro brazo. Hacemos un redondel en el antebrazo, que será donde determinemos el contaje de petequias en el caso que las hubiese.
Para ello, ensuflamos hasta la media de la medida de la presiones medidas anteriormente. Mantenemos esta presión durante 5 minutos.
Finalmente, retiramos el esfingmomanómetro y contamos las posibles petequias.
Lectura de los resultados
Las petequias se aprecian como pequeñas manchas cutáneas de color rojizo, que están constituidas por acúmulos de sangre, y que no desaparecen cuando se ejerce una compresión con el dedo sobre ellas.
Deben aparecer menos de 10.
En este caso no han aparecido ninguna, por tanto, el paciente está en perfectas condiciones.
XXXVII Determinación del tiempo de hemorragia con la técnica de Duke
Fundamento
El tiempo de hemorragia se determina efectuando una pequeña herida en la piel y seguidamente, midiendo el tiempo que tada en cesar de manar la sangre a través de la herida.
Material necesario
Gasa
Lancenta
Papel de filtro
Reloj
Tijeras
Reactivos
Alcohol
Técnica
Primeramente empapamos una gasa con alcohol y desinfectamos la zona. En este caso el lóbulo inferior de una oreja. Dejamos secar y procedemos a hacer la punción con una lanceta.
Ponemos el cronómetro y sin presionar dejamos que cese la sangre. Cada 30 segundos retiramos la sangre con papel parafilm, pero sin rozar la herida para no impedir la formación del coágulo. Repetimos el proceso hasta que al poner el papel deje de untarse de sangre. Y paramos el cronómetro.
Lectura de los resultados
Se puede hacer contando el tiempo desde poner en marcha el cronómetro hasta la finalización del mismo o contando las gotas de sangre más una y multiplicándolas por 30 segundos.
En este caso, hemos tenido 4 manchas, de modo que el tiempo transcurrido de hemorragia es de 150 segundos. Este tiempo está dentro de los valores normales, ya que estos con esta técnica se enccuentras entre 1-3 minutos.
Hoja de trabajo
1º ¿ De quién es la técnica que se utiliza, en esta práctica, para determinar el tiempo de hemorragia?
Duke
2º ¿ Cada cuánto tiempo se recoge la gota de sangre que está presente en el lóbulo de la oreja?
Cada 30 segundos
3º ¿ Cuál es el tiempo de hemorragia normal?
De 1-3 minutos
4º ¿ Qué fármaco aumenta, tras ser ingerido, el tiempo de hemorragia?
Ácido acetilsalicílico
El tiempo de hemorragia se determina efectuando una pequeña herida en la piel y seguidamente, midiendo el tiempo que tada en cesar de manar la sangre a través de la herida.
Material necesario
Gasa
Lancenta
Papel de filtro
Reloj
Tijeras
Reactivos
Alcohol
Técnica
Primeramente empapamos una gasa con alcohol y desinfectamos la zona. En este caso el lóbulo inferior de una oreja. Dejamos secar y procedemos a hacer la punción con una lanceta.
Ponemos el cronómetro y sin presionar dejamos que cese la sangre. Cada 30 segundos retiramos la sangre con papel parafilm, pero sin rozar la herida para no impedir la formación del coágulo. Repetimos el proceso hasta que al poner el papel deje de untarse de sangre. Y paramos el cronómetro.
Lectura de los resultados
Se puede hacer contando el tiempo desde poner en marcha el cronómetro hasta la finalización del mismo o contando las gotas de sangre más una y multiplicándolas por 30 segundos.
En este caso, hemos tenido 4 manchas, de modo que el tiempo transcurrido de hemorragia es de 150 segundos. Este tiempo está dentro de los valores normales, ya que estos con esta técnica se enccuentras entre 1-3 minutos.
Hoja de trabajo
1º ¿ De quién es la técnica que se utiliza, en esta práctica, para determinar el tiempo de hemorragia?
Duke
2º ¿ Cada cuánto tiempo se recoge la gota de sangre que está presente en el lóbulo de la oreja?
Cada 30 segundos
3º ¿ Cuál es el tiempo de hemorragia normal?
De 1-3 minutos
4º ¿ Qué fármaco aumenta, tras ser ingerido, el tiempo de hemorragia?
Ácido acetilsalicílico
XXVI Determinación de la velocidad de sedimentación globular ( VSG)
Fundamento
Con ésta práctica se determina la velocidad de sedimentación globular. Es una técnica muy inespecífica, señala la presencia de una enfermadad, pero no determina cual es y sus causas.
Material necesario
Gradilla especial
Tubo tapón negro
Pipeta VSG
Cronómetro
Muestra
Sangre contenida en un tubo mezclador.
Técnica
Colocamos en una gradilla especial tubo mezclador con nuestra sangre contenida en su interior.
Introducimos con cuidado la pipeta VSG, hasta que por capilaridad la sangre ascienda hasta el tope de la misma.
Observamos la hora y pasada una hora comprobamos la cantidad de sangre que ha descendido. Y repetimos la lectura pasada dos horas.
Lectura de los resultados
VSG 1º hora 0,4
VSG 2º hora 0,8
Relizamos el cálculo de indice de Katz, este se realiza de la siguiente forma:
Índice de Katz= [VSG 1º HORA+( VSG 2º HORA/2) ]/ 2
Por tanto, nuestro resultado es 0,4
Hoja de trabajo
Con ésta práctica se determina la velocidad de sedimentación globular. Es una técnica muy inespecífica, señala la presencia de una enfermadad, pero no determina cual es y sus causas.
Material necesario
Gradilla especial
Tubo tapón negro
Pipeta VSG
Cronómetro
Muestra
Sangre contenida en un tubo mezclador.
Técnica
Colocamos en una gradilla especial tubo mezclador con nuestra sangre contenida en su interior.
Introducimos con cuidado la pipeta VSG, hasta que por capilaridad la sangre ascienda hasta el tope de la misma.
Observamos la hora y pasada una hora comprobamos la cantidad de sangre que ha descendido. Y repetimos la lectura pasada dos horas.
Lectura de los resultados
VSG 1º hora 0,4
VSG 2º hora 0,8
Relizamos el cálculo de indice de Katz, este se realiza de la siguiente forma:
Índice de Katz= [VSG 1º HORA+( VSG 2º HORA/2) ]/ 2
Por tanto, nuestro resultado es 0,4
Hoja de trabajo
XXV Prueba de la sacarosa
Fundamento
Esta práctica se realiza para determinar si el paciente tiene HPN o no. Y en caso de tener, la prueba será positiva, de lo contrario, negativa. El grado de positividad oscila entre un 80-100%
Material necesario
Pipetas Pasteur
Pipetas de vidrio de 5 ml y de 2 ml
Puntas de mircropipeta
micropipeta
Un reloj
Centrífuga
Cubetas de espectrofotómetro
Rotulador de vidrio
Gradilla
Papel parafilm
Muestra
Sangre venosa total
Reactivos
Solución acuosa de sacarosa
Solución acuosa de amoniaco
Suero salino
Técnica
Rotuladmos dos tubos de vidrio con las iniciales de SF Y otro con SP.
En el tubo de SF depositamos con una pipeta de vidrio 1,8 ml de suero y con una micropipeta de 200 microlitros depositamos dicha cantidad de sangre.
En el tubo SP depositamos con una pipeta de vidrio 1,8 ml de sacarosa y con una micropipeta de 200 microlitros depositamos dicha cantidad de sangre.
Aguitamos la muestra suavemente, la tapamos y dejamos reposar durante 30 minutos. Pasado este tiempo centrifugamos los tubos a 2000 rpm durante cinco minutos.
Mientras se centrifuga preparamos tres tubos, de los cuales los identificamos con las iniciales de TB, TPr y Tpa.
A cada uno de ellos se le añade 5ml de amoniaco.
Al sacar los tubos anteriores de la centrífuga extraemos el sobrenadante 300 microlitros del mismo y lo depositamos en tubo TPr
Al tubo SF se resuspende y extraemos del mismo 300 microlitros y lo depositamos en el tubo TPa.
Una vez tenemos nuestros tres tubos finales preparados medimos su absorbancia.
Para ello depositamos una pequeña cantidad de los mismos en cubetas especiales para espectrofotómetro con ayuda de una pipeta pasteur. Ha de ser una pipeta diferente para cada mezcla.
Una vez medidos, anotamos absorbancias y realizamos la fórmula que determina el porcentaje.
Lectura de los resutados
TUBO TB 0 absorbancia
TUBO Tpa 0,206 absorbancia
TUBO Tpr 0,065 absorbancia
Fórmula es: % hemólisis = A / AM X 100
A absorbancia de tubo TPr
AM absorbancia de tubo TPa
% hemólisis = 0,065/ 0,206 x 100= 31,55%
Hoja de trabajo
1º ¿ Con qué solución se hemolizan los hematies vertidos en el tubo problema?
Con solución sacarosa
2º ¿ A qué concentración se prepara la solución de sacarosa?
9,24%
3º ¿ Cómo se llama también la sacarosa?
azúcar común
4º ¿ Qué es el ACD?
Ácido Cítrico-dextrosa
5º ¿ Cómo se prepara el tubo blanco?
Con 5ml de amoniaco junto con 300 microlitros de suero
6º ¿ Qué porcentaje de hemólisis suele producirse, con la prueba de la sacarosa, en la sangre de la HPN?
10-80%
Esta práctica se realiza para determinar si el paciente tiene HPN o no. Y en caso de tener, la prueba será positiva, de lo contrario, negativa. El grado de positividad oscila entre un 80-100%
Material necesario
Pipetas Pasteur
Pipetas de vidrio de 5 ml y de 2 ml
Puntas de mircropipeta
micropipeta
Un reloj
Centrífuga
Cubetas de espectrofotómetro
Rotulador de vidrio
Gradilla
Papel parafilm
Muestra
Sangre venosa total
Reactivos
Solución acuosa de sacarosa
Solución acuosa de amoniaco
Suero salino
Técnica
Rotuladmos dos tubos de vidrio con las iniciales de SF Y otro con SP.
En el tubo de SF depositamos con una pipeta de vidrio 1,8 ml de suero y con una micropipeta de 200 microlitros depositamos dicha cantidad de sangre.
En el tubo SP depositamos con una pipeta de vidrio 1,8 ml de sacarosa y con una micropipeta de 200 microlitros depositamos dicha cantidad de sangre.
Aguitamos la muestra suavemente, la tapamos y dejamos reposar durante 30 minutos. Pasado este tiempo centrifugamos los tubos a 2000 rpm durante cinco minutos.
Mientras se centrifuga preparamos tres tubos, de los cuales los identificamos con las iniciales de TB, TPr y Tpa.
A cada uno de ellos se le añade 5ml de amoniaco.
Al sacar los tubos anteriores de la centrífuga extraemos el sobrenadante 300 microlitros del mismo y lo depositamos en tubo TPr
Al tubo SF se resuspende y extraemos del mismo 300 microlitros y lo depositamos en el tubo TPa.
Una vez tenemos nuestros tres tubos finales preparados medimos su absorbancia.
Para ello depositamos una pequeña cantidad de los mismos en cubetas especiales para espectrofotómetro con ayuda de una pipeta pasteur. Ha de ser una pipeta diferente para cada mezcla.
Una vez medidos, anotamos absorbancias y realizamos la fórmula que determina el porcentaje.
Lectura de los resutados
TUBO TB 0 absorbancia
TUBO Tpa 0,206 absorbancia
TUBO Tpr 0,065 absorbancia
Fórmula es: % hemólisis = A / AM X 100
A absorbancia de tubo TPr
AM absorbancia de tubo TPa
% hemólisis = 0,065/ 0,206 x 100= 31,55%
Hoja de trabajo
1º ¿ Con qué solución se hemolizan los hematies vertidos en el tubo problema?
Con solución sacarosa
2º ¿ A qué concentración se prepara la solución de sacarosa?
9,24%
3º ¿ Cómo se llama también la sacarosa?
azúcar común
4º ¿ Qué es el ACD?
Ácido Cítrico-dextrosa
5º ¿ Cómo se prepara el tubo blanco?
Con 5ml de amoniaco junto con 300 microlitros de suero
6º ¿ Qué porcentaje de hemólisis suele producirse, con la prueba de la sacarosa, en la sangre de la HPN?
10-80%
XXIV Estudio de la fragilidad osmótica de los hematíes
Fundamento
Esta prácitca se realiza para poner a los hematíes frente a un medio hipotónico y comprobar su capacidad de resistencia osmótica frente al mismo. Los hematíes son capaces de resistir hasta un 70% como máximo sin hemolizarse.
Material necesario
8 tubos de ensayo
Gradilla
Rotulador de vidrio
Cubeta de espectrofotómetro
Espectrofotómetro
Vaso de precipitado
Pipeta Pasteur
Reloj
Papel Parafilm
Centrífuga
Muestra
Sangre venosa total
Reactivos
Agua destilada
Suero salino
Técnica
Rotulamos 6 tubos de ensayo con las indicaciones de:
1, 2, 3, ,16, 17 y 18.
Añadimos a cada uno de los tubos enumerados una gota de sangre de la contenida en dicho tubo con una pipeta pasteur.
Despúes, añadimos gotas de agua destilada a cada tubo. La cantidad de gotas es una menos al número indicado, es decir, al tubo numero 1 no se añaden, al tubo numero 2 se añade una gota, al tubo numero 3 dos gotas, y asi respectivamente con todos.
Después, añadimos gotas de suero salino, el número de gotas es de 18 al primero, 17 al segundo, 16 al tercero, 15 al cuarto, 4 al tubo quince, 3 al tubo 16, 2 al tubo 17 y 1 gota al tubo 18.
A continuación tapamos los tubos con papel parafilm y los dejamos reposar durante 30 minutos.
Transcurrido dicho tiempo centrifugamos los tubos a 2000 rmp durante 5 minutos.
Una vez centrifugado medimos absorbancia de cada tubo.
El tubo numero 1 tiene cero porciento de hemólisis, por tanto, será nuestra línea de base,
Para ello, utilizamos una cubeta, en la cual vamos depositando la cantidad de cada tubo en orden de identificación.
Lectura de resultados
Las absorbancias obtenidas son las siguientes:
TUBO 1
TUBO 2
TUBO 3
TUBO 16
TUBO 17
TUBO 18
Ahora realizamos la fórmula para determinar el porcentaje de hemólisis
% hemólisis = A/AM X 100
A equivale a absorbancia de cada tubo
AM equivale a absorbancia de último tubo ya que es el 100% de hemólisis.
TUBO 1 = / X 100
TUBO 2 = / X 100
TUBO 3 = / X 100
TUBO 16 = / X 100
TUBO 17 = / X 100
TUBO 18 = / X 100
Esta prácitca se realiza para poner a los hematíes frente a un medio hipotónico y comprobar su capacidad de resistencia osmótica frente al mismo. Los hematíes son capaces de resistir hasta un 70% como máximo sin hemolizarse.
Material necesario
8 tubos de ensayo
Gradilla
Rotulador de vidrio
Cubeta de espectrofotómetro
Espectrofotómetro
Vaso de precipitado
Pipeta Pasteur
Reloj
Papel Parafilm
Centrífuga
Muestra
Sangre venosa total
Reactivos
Agua destilada
Suero salino
Técnica
Rotulamos 6 tubos de ensayo con las indicaciones de:
1, 2, 3, ,16, 17 y 18.
Añadimos a cada uno de los tubos enumerados una gota de sangre de la contenida en dicho tubo con una pipeta pasteur.
Despúes, añadimos gotas de agua destilada a cada tubo. La cantidad de gotas es una menos al número indicado, es decir, al tubo numero 1 no se añaden, al tubo numero 2 se añade una gota, al tubo numero 3 dos gotas, y asi respectivamente con todos.
Después, añadimos gotas de suero salino, el número de gotas es de 18 al primero, 17 al segundo, 16 al tercero, 15 al cuarto, 4 al tubo quince, 3 al tubo 16, 2 al tubo 17 y 1 gota al tubo 18.
A continuación tapamos los tubos con papel parafilm y los dejamos reposar durante 30 minutos.
Transcurrido dicho tiempo centrifugamos los tubos a 2000 rmp durante 5 minutos.
Una vez centrifugado medimos absorbancia de cada tubo.
El tubo numero 1 tiene cero porciento de hemólisis, por tanto, será nuestra línea de base,
Para ello, utilizamos una cubeta, en la cual vamos depositando la cantidad de cada tubo en orden de identificación.
Lectura de resultados
Las absorbancias obtenidas son las siguientes:
TUBO 1
TUBO 2
TUBO 3
TUBO 16
TUBO 17
TUBO 18
Ahora realizamos la fórmula para determinar el porcentaje de hemólisis
% hemólisis = A/AM X 100
A equivale a absorbancia de cada tubo
AM equivale a absorbancia de último tubo ya que es el 100% de hemólisis.
TUBO 1 = / X 100
TUBO 2 = / X 100
TUBO 3 = / X 100
TUBO 16 = / X 100
TUBO 17 = / X 100
TUBO 18 = / X 100
Electroforesis de hemoglobina
Fundamento
La electroforesis es una técnica analítica que sirve para sepaar las moléculas en función de su carga eléctrica neta. El hemolizado se deposita sobre una tira empapada con un líquido alcalino y se aplica una corriente eléctrica que lo atraviesa. Cuando en un medio básico adquierren una carga eléctrica neta se van desplazando del cátodo al ánodo. En la sangre hay varios tipos de Hb con diferente carga, de modo que se separan en función de dicha carga y a la velocidad proporcional de la misma.
Material necesario
Gradilla
Tubos de ensayo
Vaso precipitado
Pipetas Pasteur
Papel absorbente
Agitador de tubos
Mascarilla
Papel parafilm
Capilar azul
Centrífuga
Pinzas de metal
Cubeta y fuente de alimentación
Bandejas de plástico
Agitador de bandejas
Embudo
Rodillo de metal
Estufa
Lámina de vidrio
Tiras de celulosa
Muestra
Hemolizado
Reactivos
Agua destilada
Suero salino
Cloroformo
Negro amino y/o Rojo ponceau
Tampón 8,8
Ácido acético al 5%
Metanol
Solución transparentadora
Técnica
Para preparación de hemolizado:
Añadimos 3ml de sangre en un tubo de centrífuga, tapamos con papel parafilm y centrifugamos a 3500 rpm durante 5 minutos. Retiramos sobrenadante con una pipeta pasteur y lo depositamos en un vaso de precipitado.
Después añadimos 4 ml de suero salino con una pipeta Pasteur y homogeneizamos bien. Y centrifufamos de nuevo a 3500 rmp durante cinco minutos. Repetimos el proceso dos veces más.
La tercera vez, retiramos el sobrenadante y obtenemos el sedimento comprobando que la cantidad del mismo es de 1 ml. Le añadimos 0,5 ml de cloroformo y 1,5 de agua destilada. Agitamos la mezcla con un agitador de tubos y tapamos con papel parafilm. Centrifugamos de nuevo pero esta vez, a 3500rpm durante 20 minutos.
Finalmente, retiramos el sobrenadante con una pipeta Pasteur y lo depositamos en un tubo de ensayo colocado en una gradilla. Y ya tenemos nuestro hemolizado, que será la muestra que empleemos para nuestra práctica.
Para electroforesis:
Preparamos en una bandeja tampón 8,8.
Sacamos dos tiras de celulosa con unas pinzas de metal y la introducimos en la bandeja con tampón. De forma que la parte absorbente quede hacia arriba, y la dejamos durante 10 minutos.
Retiramos la tira y la colocamos en un puente, de modo que siga estando en la misma posición. Hay que dejar que sobresalga por ambos lados del puente parte de la tira para que esté en contacto con la solución presente en la bandeja. En la parte donde tiene un corte la tira hacemos una señal con un rotulador de vidrio y depositamos con un capilar azul por encima de la misma una pequeña cantidad de nuestro hemolizado. Introducimos el puente en bandeja de fuente de alimentación de modo que el extremo del corte quede en el lugar del cable negro. Conectamos los cables y programamos aparato a 400 voltios durante 20 minutos.
Sacamos la tira cuidadosamente, y de forma invertica la depositamos en una bandeja con Rojo ponceau durante diez minutos. Para que se tiña bien colocamos la bandeja en un agitador de bandejas.
Pasado ese tiempo la introducimos en una bandeja que contiene acido acetico durante 10 minutos. Esto lo repetimos dos veces mas.
Después colocamos la tira en una bandeja con metanol durante un minuto.
después en otra bandeja con transparentadora durante 3 minutos
A continuación retiramos la tira con unas pinzas de metal y la colocamos en una placa de vidrio. para que quede bien adherida utilizamos un rodillo de metal.
La introducimos en la estufa durante 5 minutos a 60 grados y ya tenemos la práctica realizada y podemos determinar la cantidad y tipos de hemoglobina presentes en la muestra del paciente.
La electroforesis es una técnica analítica que sirve para sepaar las moléculas en función de su carga eléctrica neta. El hemolizado se deposita sobre una tira empapada con un líquido alcalino y se aplica una corriente eléctrica que lo atraviesa. Cuando en un medio básico adquierren una carga eléctrica neta se van desplazando del cátodo al ánodo. En la sangre hay varios tipos de Hb con diferente carga, de modo que se separan en función de dicha carga y a la velocidad proporcional de la misma.
Material necesario
Gradilla
Tubos de ensayo
Vaso precipitado
Pipetas Pasteur
Papel absorbente
Agitador de tubos
Mascarilla
Papel parafilm
Capilar azul
Centrífuga
Pinzas de metal
Cubeta y fuente de alimentación
Bandejas de plástico
Agitador de bandejas
Embudo
Rodillo de metal
Estufa
Lámina de vidrio
Tiras de celulosa
Muestra
Hemolizado
Reactivos
Agua destilada
Suero salino
Cloroformo
Negro amino y/o Rojo ponceau
Tampón 8,8
Ácido acético al 5%
Metanol
Solución transparentadora
Técnica
Para preparación de hemolizado:
Añadimos 3ml de sangre en un tubo de centrífuga, tapamos con papel parafilm y centrifugamos a 3500 rpm durante 5 minutos. Retiramos sobrenadante con una pipeta pasteur y lo depositamos en un vaso de precipitado.
Después añadimos 4 ml de suero salino con una pipeta Pasteur y homogeneizamos bien. Y centrifufamos de nuevo a 3500 rmp durante cinco minutos. Repetimos el proceso dos veces más.
La tercera vez, retiramos el sobrenadante y obtenemos el sedimento comprobando que la cantidad del mismo es de 1 ml. Le añadimos 0,5 ml de cloroformo y 1,5 de agua destilada. Agitamos la mezcla con un agitador de tubos y tapamos con papel parafilm. Centrifugamos de nuevo pero esta vez, a 3500rpm durante 20 minutos.
Finalmente, retiramos el sobrenadante con una pipeta Pasteur y lo depositamos en un tubo de ensayo colocado en una gradilla. Y ya tenemos nuestro hemolizado, que será la muestra que empleemos para nuestra práctica.
Para electroforesis:
Preparamos en una bandeja tampón 8,8.
Sacamos dos tiras de celulosa con unas pinzas de metal y la introducimos en la bandeja con tampón. De forma que la parte absorbente quede hacia arriba, y la dejamos durante 10 minutos.
Retiramos la tira y la colocamos en un puente, de modo que siga estando en la misma posición. Hay que dejar que sobresalga por ambos lados del puente parte de la tira para que esté en contacto con la solución presente en la bandeja. En la parte donde tiene un corte la tira hacemos una señal con un rotulador de vidrio y depositamos con un capilar azul por encima de la misma una pequeña cantidad de nuestro hemolizado. Introducimos el puente en bandeja de fuente de alimentación de modo que el extremo del corte quede en el lugar del cable negro. Conectamos los cables y programamos aparato a 400 voltios durante 20 minutos.
Sacamos la tira cuidadosamente, y de forma invertica la depositamos en una bandeja con Rojo ponceau durante diez minutos. Para que se tiña bien colocamos la bandeja en un agitador de bandejas.
Pasado ese tiempo la introducimos en una bandeja que contiene acido acetico durante 10 minutos. Esto lo repetimos dos veces mas.
Después colocamos la tira en una bandeja con metanol durante un minuto.
después en otra bandeja con transparentadora durante 3 minutos
A continuación retiramos la tira con unas pinzas de metal y la colocamos en una placa de vidrio. para que quede bien adherida utilizamos un rodillo de metal.
La introducimos en la estufa durante 5 minutos a 60 grados y ya tenemos la práctica realizada y podemos determinar la cantidad y tipos de hemoglobina presentes en la muestra del paciente.
PRÁCTICA XVIII: Cálculo de los índices eritrocitarios
Fundamento
Con los índices eritrocitarios primarios RBC Y HTO, podemos obtener el VCM, y la CHCM. Y por tanto, determinar si se está en los valores normales, y si no es así, determinar la posible enfermedad que padece el paciente al que se le está realizando la prueba con los valores obtenidos de los mismos.
Material
Cámara de Neubauer
Pipeta de Thoma
Cubre
Vaso precipitado
Gradilla
Bolígrafo
Papel
Tubos de ensayo
Capilar
Plastilina
Centrífuga de micrométrico
Lector o regla
Micropipetas
Puntas para micropipetas
pipetas de vidrio
Espectrofotómetro
Muestra
Sangre venosa total
Reactivos
Agua destilada
Hayem
Drabkin
Patrón de hemoglobina a 15g/dl
Técnica
Para RBC:
Llenamos pipeta de Thoma hasta la señal de 0,5 de sangre y el resto hasta la señal de 101 de líquido de dilución Hayem.
Movemos durante 3 minutos en movimientos suaves.
Desechamos las tres primeras gotas en una gasa.
Colocamos un cubre en cámara de recuento e introducimos una pequeña cantidad de la muestra dentro de la misma. Debe introducirse por si misma por capilaridad.
Dejamos reposar la muestra unos minutos y visualizamos con el microscopio con objetivo de 40x.
NUESTRO RESULTADO: 123500
Para HTO:
Llenamos las tres cuartas partes de un capilar con sangre total y tapamos con plastilina el extremo por donde hemos introducido la misma. Centrifugamos a 10500 rpm durante 5 minutos en una centrifuga para hematocrito. Finalmente, medimos la fracción forme con un lector o una regla.
NUESTRO RESULTADO: 18%
Para Concentración de hemoglobina:
Preparamos cuatro tubos en una gradilla.
Identificamos los mismos con las letras de Reactivo, Patrón, muestra y agua destilada
En Reactivo depositamos 2,5 ml de drabkin
En Patrón depositamos 2,5 ml de drabkin mas 10 microlitros de patrón 15 g/dl
En muestra depositabmos 2,5 ml de drabkin más 10 microlitros de sangre
En agua destilada depositamos una pequeña cantidad de la misma para finalizar medición de espectrofotometría.
NUESTRO RESULTADO: 18,58 g/dl
Una vez tenemos estos cálculos primarios realizamos el cálculos de los índices eritrocitarios secundarios, que son:
Volumen corpuscular medio VCM= HTO/ RBC x 10
Hemoglobina corpuscular media HCM= [Hb] / RBC x 10
Concentración de hemoglobina corpuscular media CHCM = [Hb]/ HTO x 100
Lectura de resultados
Los valores normales de VCM se sitúan en 80-100 fl
en este caso nos ha dado: 145, 74 fl
Este resultado está por encima de los valores normales por tanto el paciente tiene macrocitosis
Los valores normales de HCM se sitúan en 27-31 pg
en este caso nos ha dado: 142, 26 pg
Este resultado está por encima de los valores normales por tanto el paciente tiene hipercromía relativa
Los valores normales de CHCM se sitúan en 32-36 g/dl
en este caso nos ha dado: 103,22 pg
Este resultado está por encima de los valores normales por tanto el paciente tiene hepercromía absoluta
Con los índices eritrocitarios primarios RBC Y HTO, podemos obtener el VCM, y la CHCM. Y por tanto, determinar si se está en los valores normales, y si no es así, determinar la posible enfermedad que padece el paciente al que se le está realizando la prueba con los valores obtenidos de los mismos.
Material
Cámara de Neubauer
Pipeta de Thoma
Cubre
Vaso precipitado
Gradilla
Bolígrafo
Papel
Tubos de ensayo
Capilar
Plastilina
Centrífuga de micrométrico
Lector o regla
Micropipetas
Puntas para micropipetas
pipetas de vidrio
Espectrofotómetro
Muestra
Sangre venosa total
Reactivos
Agua destilada
Hayem
Drabkin
Patrón de hemoglobina a 15g/dl
Técnica
Para RBC:
Llenamos pipeta de Thoma hasta la señal de 0,5 de sangre y el resto hasta la señal de 101 de líquido de dilución Hayem.
Movemos durante 3 minutos en movimientos suaves.
Desechamos las tres primeras gotas en una gasa.
Colocamos un cubre en cámara de recuento e introducimos una pequeña cantidad de la muestra dentro de la misma. Debe introducirse por si misma por capilaridad.
Dejamos reposar la muestra unos minutos y visualizamos con el microscopio con objetivo de 40x.
NUESTRO RESULTADO: 123500
Para HTO:
Llenamos las tres cuartas partes de un capilar con sangre total y tapamos con plastilina el extremo por donde hemos introducido la misma. Centrifugamos a 10500 rpm durante 5 minutos en una centrifuga para hematocrito. Finalmente, medimos la fracción forme con un lector o una regla.
NUESTRO RESULTADO: 18%
Para Concentración de hemoglobina:
Preparamos cuatro tubos en una gradilla.
Identificamos los mismos con las letras de Reactivo, Patrón, muestra y agua destilada
En Reactivo depositamos 2,5 ml de drabkin
En Patrón depositamos 2,5 ml de drabkin mas 10 microlitros de patrón 15 g/dl
En muestra depositabmos 2,5 ml de drabkin más 10 microlitros de sangre
En agua destilada depositamos una pequeña cantidad de la misma para finalizar medición de espectrofotometría.
NUESTRO RESULTADO: 18,58 g/dl
Una vez tenemos estos cálculos primarios realizamos el cálculos de los índices eritrocitarios secundarios, que son:
Volumen corpuscular medio VCM= HTO/ RBC x 10
Hemoglobina corpuscular media HCM= [Hb] / RBC x 10
Concentración de hemoglobina corpuscular media CHCM = [Hb]/ HTO x 100
Lectura de resultados
Los valores normales de VCM se sitúan en 80-100 fl
en este caso nos ha dado: 145, 74 fl
Este resultado está por encima de los valores normales por tanto el paciente tiene macrocitosis
Los valores normales de HCM se sitúan en 27-31 pg
en este caso nos ha dado: 142, 26 pg
Este resultado está por encima de los valores normales por tanto el paciente tiene hipercromía relativa
Los valores normales de CHCM se sitúan en 32-36 g/dl
en este caso nos ha dado: 103,22 pg
Este resultado está por encima de los valores normales por tanto el paciente tiene hepercromía absoluta
PRÁCTICA XXXII: Estudio de concentrado de leucocitos
Fundamento
Esta práctica se realiza para determinar posibles patologías en las células leucocitarias.
Material necesario
Un tubo de centrífuga
una centrífuga
Una pipeta Pasteur de Plástico
Una micorpipeta
Puntas desechables de micorpipeta
Portaobjetos
Gradilla
Reactivos
Tinción de Panóptico Rápido
Muestra
Sangre total
Técnica
1º Depositamos la sangre en un tubo de centrífuga y centrifugamos a 3500 rpm durante 10 minutos.
2º Retiramos el sobrenadante con una pipeta pasteur y lo desechamos en un vaso de precipitado.
3º Retiramos buffy coat, en este caso, que es lo que nos interesa para ésta práctica, con una micropipeta y, con mucho cuidado de no extraer la fracción forme.
4º Depositamos una pequeña cantidad de la misma en un portaobjetos, realizamos extensión, y teñimos con panñoptico rápido.
5º Visualizamos al microscopio con objetivo de 40x.
Lectura de resultados
Podemos observar los diferentes tipos de leucocitos y múltiples plaquetas, ya que estas también se encuentran en esta porción de la centrifugación de la sangre.
Hoja de trabajo
1º ¿ Cómo se llama a la condensación del material genético inactivo de un cromosoma X?
Cropúsculo de Barr
2º¿ Qué nombre recibe la capa leucoplaquetaria?
Buffy coat
3º Tras centrifugar la sangre, ¿ En qué capa se sitúan los hematíes?
en la capa inferior
Esta práctica se realiza para determinar posibles patologías en las células leucocitarias.
Material necesario
Un tubo de centrífuga
una centrífuga
Una pipeta Pasteur de Plástico
Una micorpipeta
Puntas desechables de micorpipeta
Portaobjetos
Gradilla
Reactivos
Tinción de Panóptico Rápido
Muestra
Sangre total
Técnica
1º Depositamos la sangre en un tubo de centrífuga y centrifugamos a 3500 rpm durante 10 minutos.
2º Retiramos el sobrenadante con una pipeta pasteur y lo desechamos en un vaso de precipitado.
3º Retiramos buffy coat, en este caso, que es lo que nos interesa para ésta práctica, con una micropipeta y, con mucho cuidado de no extraer la fracción forme.
4º Depositamos una pequeña cantidad de la misma en un portaobjetos, realizamos extensión, y teñimos con panñoptico rápido.
5º Visualizamos al microscopio con objetivo de 40x.
Lectura de resultados
Podemos observar los diferentes tipos de leucocitos y múltiples plaquetas, ya que estas también se encuentran en esta porción de la centrifugación de la sangre.
Hoja de trabajo
1º ¿ Cómo se llama a la condensación del material genético inactivo de un cromosoma X?
Cropúsculo de Barr
2º¿ Qué nombre recibe la capa leucoplaquetaria?
Buffy coat
3º Tras centrifugar la sangre, ¿ En qué capa se sitúan los hematíes?
en la capa inferior
PRACTICA XVII : Determninación de hemoglobina en sangre ( 19 - 01 - 15 )
Fundamento
Posteriormente , y en presencia de cianuro potásico , la metahemoglobina pasa a cianmetahemoglobina.
Éste es un compuesto estable , de color rojo , con un pico de absorcion maximo a 540 y cuya concentracion puede ser determinada por métodos colorimétricos empleando un patrón de concentración conocida.
Material necesario
Reactivos
Muestra
Sangre capilar o venosa anticoagulada con EDTA , heparina u oxalato .
Técnica
Lectura de resultados
Cálculos
D.O PR
----------- X 20 = g de hemoglobina / dl
D.O ST
Interpretación clínica de los resultados
En este caso es preferible hablar de valores de referencia, ya que existen valores notables entre zonas gográficas y grupos étnicos donde existen ciertas anemias carenciales que afectan a un número elevado de la población .
Hoja de trabajo
¿ En qué se basan los métodos de determinación de la hemoglobina?
Se basa en la transformación de hemoglobina en cianmetahemoglbina
¿Cuál es el método recomendado por el comité internacional para la estandarización de la hematología?
cianmetahemoglbina
¿D e dónde procede el 20 de la fórmula para calcular la concentración ?
procede del estándar que se lee directamente , sin mezclar con reactivos , ya que está preparado como cianmetahemoglobina equivalente a una concentración de HB de 20g/dl.
- Se basa en la transformación de hemoglobina en cianmetahemoglbina mediante los siguientes pasos :
Posteriormente , y en presencia de cianuro potásico , la metahemoglobina pasa a cianmetahemoglobina.
Éste es un compuesto estable , de color rojo , con un pico de absorcion maximo a 540 y cuya concentracion puede ser determinada por métodos colorimétricos empleando un patrón de concentración conocida.
Material necesario
- Tubos de ensayo
- Pipetas de seguridad
- Espectofotómetro
- Cubetas para colorimetria
Reactivos
- Reactivo de Drabkin
- Estándar equivalente a 20g de hemoglobina / dl
Muestra
Sangre capilar o venosa anticoagulada con EDTA , heparina u oxalato .
Técnica
- Ajustar el espectrofotómetro a cero frente a agua destilada
- Hay dos métodos de hacerlo , pero nosotros vamos a utilizar el método micro .
- Preparamos 4 tubs rotulados como blanco (B) , Patrón (P) , m1 y m2
- Tendremos gran precaución al pipetear reactivo de Drabkin , ya que contiene cianuro potásico y es muy tóxico.
- Añadimos 2,5 ml de Drabkin a los 4 tubos , a todos
- añadimos 10 ul de ptrón (calibrador) bote marrón pequeño a : m1 , m2 y patrón
- Mezclamos bien y dejamos incubar a temperatura ambiente 10min .
- El tubo BR es el blanco de ractivos , porque el reactivo de Drabkin es de color amarillo , y aunque en condiciones normales su absorbancia debe ser cero , nos aseguramos de no incluir errores en la técnica y hacemos la lectura del problema frente a el .
- El tubo PR es el problema , y contiene la muestra y el reactivo de Drabkin , el color es estable durante 8 horas.
- El estándar se lee directamente , sin mezclar con reactivos , ya que está preparado como cianmetahemoglobina equivalente a una concentración de HB de 20g/dl.
- Dado que no precisa manipulación y que es estable en condiciones de conservación adecuadas , no es necesario medir su absorbancia. ( D: 0 ). En cada determinación .
- Bastará con hacer una lectura diaria e inlcuir este dato en determinaciones posteriores ( D.0ST)
Lectura de resultados
- Se echa el contenido de los tubos en las cubetas de espectofometría y se hace la lectura a 540 nm.
Cálculos
D.O PR
----------- X 20 = g de hemoglobina / dl
D.O ST
Interpretación clínica de los resultados
- Los valores normales son :
- Hombres : 14-18 g/dl
- Mujeres : 11-16 g / dl
- Niños : 10 -14 g / dl
En este caso es preferible hablar de valores de referencia, ya que existen valores notables entre zonas gográficas y grupos étnicos donde existen ciertas anemias carenciales que afectan a un número elevado de la población .
Hoja de trabajo
¿ En qué se basan los métodos de determinación de la hemoglobina?
Se basa en la transformación de hemoglobina en cianmetahemoglbina
¿Cuál es el método recomendado por el comité internacional para la estandarización de la hematología?
cianmetahemoglbina
¿D e dónde procede el 20 de la fórmula para calcular la concentración ?
procede del estándar que se lee directamente , sin mezclar con reactivos , ya que está preparado como cianmetahemoglobina equivalente a una concentración de HB de 20g/dl.
PRACTICA XXXIII : Detección de crioglobulinas ()
Fundamento
Material
Muestra ( tubo seco , sangre roja sin anticoagulante , tubo ----rojo o marrón ) .
Técnica
Lectura de resultados
Interpretación clínica de los resultados obtenidos
Hoja de trabajo
¿ A qué temperatura se debe someter el suero para una detección de crioglobulinas ?
A una temperatura entre 4º y 6º C
Si el precipitado no se reabsorbe con color , ¿ de qué sistancia está formado ?
...
¿Cuántas cruces se le asigna a un suero de aspecto lechoso ?
3 cruces
¿ A qué concentración sérica suele encontrarse las crioglobulinas tipo I ?
Se encuentran en el suero a una concentración de > 5 mg / ml
¿ Qué manifestaciones clínicas puede producir una crioglobulinemia ?
Aumento de la viscosidad de la sangre , precipitación de las crioglobulinas , depósitos de inmunocomplejos .
- Las crioglobulinas son inmunoglobulinas aisladas , o complejos inmunes qu están alterados , esta alteración hace que se vuelvan insolubles y precipiten en el suero cuando estan expuestas a una temperatura inferior a la normal del cuerp humano ( 37 ºC) .
- La detección de crioglobulinas se basa en la exposición del suero problema a la acción de una temperatura baja ( unos 4ºC ) es a la tª que las crioglobulinas precipitan más .
- Si el suero problema contiene crioglobulinas , éstas precipitan con el frío , y el precipitado formado adopta partículas blanquecinas .
Material
- Una pipeta pasteur
- Un tubo de ensayo
- Una gradilla
- Una nevera
- Un baño de agua
- Un capilar de microhematocrito no heparinizado ( capilar azul)
- Plastilina
- Una centrifuga de microhematocrito
- Una regla o un lector de microhematocrito
Muestra ( tubo seco , sangre roja sin anticoagulante , tubo ----rojo o marrón ) .
- Suero transparente ,obtenido de sangre coaguladacompletamente a temperatura corporal , y separado del coágulo en un ambiente cálido.
- Es importante evitar que la coagulación se produzca en un ambiente frio , pues esto puede dar lugar a la formación de una peuqeña cantidad de crioglobulinas .
Técnica
- Depositar el suero problema en un tubo de ensallo
- Colocar el suero problema en una nevera entre 4º y 6º .
- Examinar el tubo a los 30 min , y después cada día durante 6 días .
Lectura de resultados
- Si aparecen partículas blanquecinas en el suero , ëste ha de ser incubado a 37 º C
- Cuando no desaparezcan las partículas tras la incubación , se considera que ésta se debe a restos de fibrina.
- Sin embargo, cuando las partículas desaparecen , se estima que son crioglobulinas precipitadas ( prueba positiva ) .
- El grado de positividad de la prueba puede ser establecido de la siguiente manera :
ASPECTO DEL SUERO
|
GRADO DE POSITIVIDAD
|
Discretamente turbio
|
+
|
Francamente turbio
|
++
|
Lechoso
|
+++
|
En el caso de que la prueba sea positiva , puede realizarse una semicuantificación de las crioglobulinas presentes en el suero , mediante la determinación del criocrito .
Esta se mide de la siguiente manera :
- Llenar el tubo capilar de microhematocrito con el suero problema , hasta las 3/4 partes de su longitud
- Sellar con plastilina el extremo del tubo por el que ha entrado el suero .
- Enfriar en tubo a 4º -6º C , hasta que se produzca la precipitación máxima de crioglobulinas
- Centrifugar el tubo a unas 12 000 g durante 5 minutos
- Calcular el porcentaje que supone la columna de precipitado , con respecto a la columna total del suero.
Interpretación clínica de los resultados obtenidos
- Las crioglobulinas tipo I se asocian a transtornos proliferativos ( mieloma múltilple ... )
- Las crioglobulinas tipo II pueden ser idiopáticas o secundarias a distintas enfermedades ( transtornos proliferativos ...)
- Las crioglobulinas tipo III suelen estar relacioadas con enfermadades sistémicas y con procesos autoinmunes.
- Aumento de la viscosidad de la sangre
- Preccipitación de las crioglo bulinas
- Depósito de inmunocomplejos
Hoja de trabajo
¿ A qué temperatura se debe someter el suero para una detección de crioglobulinas ?
A una temperatura entre 4º y 6º C
Si el precipitado no se reabsorbe con color , ¿ de qué sistancia está formado ?
...
¿Cuántas cruces se le asigna a un suero de aspecto lechoso ?
3 cruces
¿ A qué concentración sérica suele encontrarse las crioglobulinas tipo I ?
Se encuentran en el suero a una concentración de > 5 mg / ml
¿ Qué manifestaciones clínicas puede producir una crioglobulinemia ?
Aumento de la viscosidad de la sangre , precipitación de las crioglobulinas , depósitos de inmunocomplejos .
martes, 24 de marzo de 2015
PRACTICA XIX : Determinación de la sideremia
Fundamento
En primer lugar el hierro férrico presente en la muestra y unido a la transferrina es liberado por la acción guanidinio.
Seguidamente , el hierro férrico libre es reducido a ferroso por la hidroxiklamina.
Posteriormente , el hierro ferroso reacciona con la ferrozina para producir un complejo coloreado .
Finalmente la intensidad , de formación del complejocoloreado es medida espectrofometricamente .
Material necesario
Reactivos
es estable 1 meses atemperatura ambiente .
Muestra
Técnica
CALCULOS
(A) muestra - (A ) blanco de muestra
--------------------------------------------------- x 100 ( conc patron ) = ug / dl de hierro
( A) patrón
En primer lugar el hierro férrico presente en la muestra y unido a la transferrina es liberado por la acción guanidinio.
Seguidamente , el hierro férrico libre es reducido a ferroso por la hidroxiklamina.
Posteriormente , el hierro ferroso reacciona con la ferrozina para producir un complejo coloreado .
Finalmente la intensidad , de formación del complejocoloreado es medida espectrofometricamente .
Material necesario
- 4 tubos de plástico de un sólo uso
- rotulador de vidrio
- 2 pipetas graduadas de un ml
- 1 pipeta automática de 200 micro litros
- puntas de pipeta automática
- 5 cubetas de espectrofotometria
- un espectrofotómetro
Reactivos
- Reactivo 1
- Tampón , acetato 100 mmol/L
- Es irritante por lo que hay que evitar el contacto con la piel o con los ojos.
- Reactivo 2
- Reductor , Ácido ascórbico 99,7%
- Reactivo 3
- color , Ferrozine 40 mmol/L
es estable 1 meses atemperatura ambiente .
Muestra
- Suero o plasma heparinizado
- No son válidas las muestras hemolizadas.
Técnica
- ajustar el espectrofotómetro a cero con agua destilada
- Llevar los reactivos , el patrón y la muestra a temperatura ambiente o a 37ºC
- Rotular 4 tubos de ensayo con las siglas BR ( blanco de reactivo ) , P ( patrón ) , BM ( blanco de muestra ) y M ( muestra )
- pipetear a cada tubo lo siguiente :
----------------------
|
Blanco de reactivo BR
|
Tubo de patrón P
|
Blanco de muestra BM
|
Tubo de muestra M
|
1,0
|
1,0
|
1,0
|
1,0
|
|
1
|
1
|
-
|
1
|
|
200
|
-
|
|||
patrón ( ul )
|
-
|
200
|
-
|
|
muestra ( ul)
|
1
|
1
|
200
|
200
|
- Agitar el contenido d los tubos
- Dejar que reaccionen los componentes de todos los tubos , durante 5 min , a temperatura ambiente
- Ajustar el espectrofotómetro a 560 nm
- disponer el contenido de los tubos en cubetas de espectrofotometria
- Leer la abssorbancia (A)
CALCULOS
(A) muestra - (A ) blanco de muestra
--------------------------------------------------- x 100 ( conc patron ) = ug / dl de hierro
( A) patrón
jueves, 12 de marzo de 2015
PRACTICA XXXV : Recuento de plaquetas con hemocitómetro ()
Fundamento

Material necesario
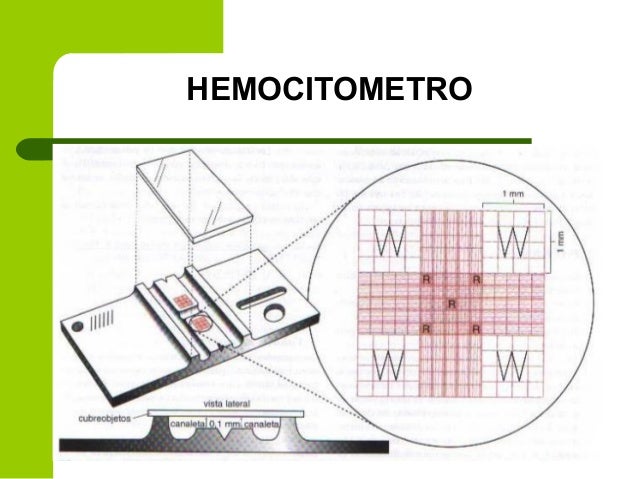
Reactivos

Muestra

Técnica
1 . Verter en un tubo de ensayo , el volumen necesario de líquido de dilución para efectuar los ensayos requeridos ( aprox. 1 ml para cada determinación ) .
El volumen de líquido de dilución sobrante no ha de ser reintegrado al frasco donde estaba envasado , para no contaminar el resto de líquido de dilución .
2 . Con una pipeta diluidora de Thoma , aspirar la muestra de sangre , adecuadamente homogeneizada hasta la señal de 1 .
3 . Limpiar con una gasa la sangre adherida al exterior de la pipeta .
4 . Aspirar el líquido de dilución hasta la señal de 101 de la pipeta .
5 . Agitar la pipeta , con movimientos de suave inversión ( 5 min.aprox.) .
6 . Desechar las primeras 5 gotas de dilución que salen de la pipeta .
7 . Cargar , correctamente , una cámara de recuento , con la dilución de sangre que queda en la pipeta .
8 . Colocar la cámara de recuento cargada , en el interior de una cámara húmeda .
9 . Dejar reposar la cámara de recuento cargada , durante 15min.
10 . Colocar la cámara de recuento sobre la platina del microscopio.
11 . Enfocar uno de los retículos de la cámara de recuento , con un objetivo de bajo aumento ( 10 x)
Con este objetivo se observa la homogeneidad de la distribución celular , de forma que , si esta no es satisfactoria , se efectua una nueva dilución de la muestra .
12 . Enfocar uno de los cuadrados grandes del retículo ( por ejemplo el central ) , con el objetivo de mediano aumento ( 40x ) .
13 . Contar la totalidad de plaquetas situadas en ese cuadrado grande .

Lectura de resultados
PLT /mm3 = P x V x D = P x 100
PLT/mm3 = número de plaquetas por mm3 de sangre
P = número de plaquetas contadas en cuadrado grande
V = corrección de dilución ( 100 )

Hoja de trabajo
Resultados obtenidos

( apuntes para repasar ) recordatorio
Valoración de los resultados
-bajo
-normal
-alto
- Para el recuento en cámara de plaquetas , se diluye la sangre problema en un líquido apropiado y , posteriormente se se deposita en la cámara de recuento , donde se cuentan las células presentes en algunos de los cuadrados de los retículos.

Material necesario
- Un tubo de ensayo preferentemente de plástico .
- Una pipeta diluidora de thoma ,para recuento de glóbulos rojos .
- Un tubo de goma con boquilla , adaptable a la pipeta diluidora .
- Gasas .
- Una cámara de reccuento , con un retículo tipo Nevauer mejorado .
- Un cubreobjetos .
- Un microscopio ( preferentemente de contraste de fases ) .
- Una placa de petri .
- Papel de filtro .

Reactivos
- Agua destilada
- Líquido de dilución . Hay varias soluciones que pueden emplearse para el recuento de trombocitos .
- En esta práctica se recomienda el uso de líquido de dilución suministrado por los laboratorios Spinreact.
- Este líquido rompe los hematíes , evita la agregación de las plaquetas entre si , y su adhesión a otros elementos , y facilita la visualización de las plaquetas al hacrlas refringentes .
Muestra
- Sangre capilar o sangre venosa recogida recientemente y recogida en un tubo con EDTA - K3
Técnica
1 . Verter en un tubo de ensayo , el volumen necesario de líquido de dilución para efectuar los ensayos requeridos ( aprox. 1 ml para cada determinación ) .
El volumen de líquido de dilución sobrante no ha de ser reintegrado al frasco donde estaba envasado , para no contaminar el resto de líquido de dilución .
2 . Con una pipeta diluidora de Thoma , aspirar la muestra de sangre , adecuadamente homogeneizada hasta la señal de 1 .
3 . Limpiar con una gasa la sangre adherida al exterior de la pipeta .
4 . Aspirar el líquido de dilución hasta la señal de 101 de la pipeta .
5 . Agitar la pipeta , con movimientos de suave inversión ( 5 min.aprox.) .
6 . Desechar las primeras 5 gotas de dilución que salen de la pipeta .
7 . Cargar , correctamente , una cámara de recuento , con la dilución de sangre que queda en la pipeta .
8 . Colocar la cámara de recuento cargada , en el interior de una cámara húmeda .
9 . Dejar reposar la cámara de recuento cargada , durante 15min.
10 . Colocar la cámara de recuento sobre la platina del microscopio.
11 . Enfocar uno de los retículos de la cámara de recuento , con un objetivo de bajo aumento ( 10 x)
Con este objetivo se observa la homogeneidad de la distribución celular , de forma que , si esta no es satisfactoria , se efectua una nueva dilución de la muestra .
12 . Enfocar uno de los cuadrados grandes del retículo ( por ejemplo el central ) , con el objetivo de mediano aumento ( 40x ) .
13 . Contar la totalidad de plaquetas situadas en ese cuadrado grande .

Lectura de resultados
- Los trombocitos se observan como corpúsculos , redondeados u ovalados , de tamaño muy pequeño y muy refringentes .
- Hay que procurar no confundirlos con leucocitos , restos eritrocitarios , o con partículas de polvo .
PLT /mm3 = P x V x D = P x 100
PLT/mm3 = número de plaquetas por mm3 de sangre
P = número de plaquetas contadas en cuadrado grande
V = corrección de dilución ( 100 )
- Si la cifra de plaquetas obtenidas es , sospechosamente muy reducida , se efectúa con una dilución menor de la muestra y se cuentan las plaquetas contenidas en varios cuadrdos grandes .
- Si por el contrario , la cifra de plaquetas obtenida , es sospechosamente alta , se efectúa una dilución mayor de la muestra .

Hoja de trabajo
- ¿ Qué tipo de pipeta diluidora se utiliza en el recuento de plaquetas ?
- Se utililiza la pipeta diluidora de Thoma , para recuento de glóbulos rojos .
- ¿ Qué funciones desempeña el líquido de dilución empleado ?
- Rompe los hematíes , evita la agregación de las plaquetas entre sí , y su adhesión a otros elementos así como mejora la visualización de las plaquetas al hacerlas refringentes .
- ¿ Cuánto líquido de dilución se necesita para efectuar un ensayo ?
- Aproximadamente 1 ml para cada determinación
- ¿Con qué se puede preparar una cámara húmeda ?
- Con una cámara de petri cerrada , y dentro de ella un papel de filtro humedecido
- ¿Con qué objetivo se cuentan las plaquetas ?
- Con el objetivo de 40x
- ¿Cómo se parecian los trombocitos en este recuento ?
- Se observan como corpúsculos redondeados , de tamaño muy pequeño y refringente
Resultados obtenidos
- Número de plaquetas contadas en un cuadrado grande
- Número de plaquetas por mm3 de sangre
( apuntes para repasar ) recordatorio
Valoración de los resultados
-bajo
-normal
-alto
Suscribirse a:
Comentarios (Atom)